Для цитирования:
Пищулин А.А., Карпова Е.А. Овариальная гиперандрогения и метаболический синдром // РМЖ. 2001. №2. С. 93
Эндокринологический научный центр РАМН, Москва
С индром овариальной гиперандрогении неопухолевого генеза или гиперандрогенная дисфункция яичников, называемый ранее синдромом Штейна - Левенталя, в настоящее время, согласно классификации ВОЗ, больше известен в мировой литературе, как синдром поликистозных яичников (СПЯ).
Клиническая картина СПЯ проявляется хроническим ановуляторным состоянием яичников или выраженной гипофункцией желтого тела, что приводит к двустороннему увеличению размеров яичников с утолщением и склерозом белочной оболочки. Эти изменения проявляются нарушением менструальной функции - опсоменореей, аменореей, однако не исключается и развитие метроррагии. Нарушения фолликулогенеза приводят к развитию ановуляторного первичного или вторичного бесплодия.
Одним из основных диагностических критериев СПЯ является гиперандрогенемия - повышение уровня андрогенных стероидов в крови (таких как тестостерон, андростендион), что приводит к развитию гирсутизма и других андрогензависимых дермопатий.
Ожирение или избыточная масса тела часто сопутствуют СПЯ. Определение индекса массы тела (ИМТ) позволяет выявить степень ожирения. Измерение показателей объема талии (ОТ) и бедер (ОБ) и их соотношение указывает на тип ожирения (прогностически неблагоприятным является абдоминальный тип ожирения, при котором ОТ/ОБ > 0,85).
Кроме основных симптомов заболевания, клиническая картина во многом определяется общими обменными нарушениями, такими как дислипидемия, нарушение углеводного обмена, повышенным риском развития гиперпластических и опухолевых процессов со стороны гениталий. Дислипидемия заключается в повышении уровня триглицеридов, холестерина, липопротеидов низкой плотности, липопротеидов очень низкой плотности и снижении липопротеидов высокой плотности. Эти нарушения ведут к риску раннего развития атеросклеротических изменений сосудов, гипертонической болезни и ишемической болезни сердца.
Нарушения углеводного обмена заключаются в развитии комплекса инсулинорезистентность-гиперинсулинемия, что в последнее время является основным направлением в изучении патогенетических звеньев развития СПЯ.
В 60-х годах патогенез СПЯ связывали с первичным ферментативным дефектом овариальной 19-гидроксилазы и/или 3b-дегидрогеназы, объединяя эти нарушения в понятие первичного поликистоза яичников. Однако в работах последующих лет было показано, что ароматазная активность клеток гранулезы является ФСГ зависимой функцией.
Выявленный при СПЯ повышенный уровень лютенизирующего гормона (ЛГ), отсутствие его овуляторного пика, нормальный или сниженный уровень фолликулостимулирующего гормона (ФСГ) при нарушенном соотношении ЛГ/ФСГ (2,5-3) предполагал первичное нарушение гонадотропной регуляции стероидогенеза в овариальной ткани с развитием вторичного поликистоза яичников.
До середины 80-х годов считалось (теория S.S.C. Yen) , что пусковым механизмом в патогенезе СПЯ является избыточный синтез андрогенов надпочечниками в период адренархе в результате измененной чувствительности надпочечников к АКТГ или чрезмерной стимуляции сетчатой зоны коры надпочечников не АКТГ-подобным фактором или под влиянием b-эндорфинов , нейротрансмиттеров, например, дофамина . При достижении критической массы тела (особенно при превышении ее нормы) увеличивается периферическая конверсия андрогенов в эстрогены, прежде всего в печени и жировой ткани . Повышение уровня эстрогенов, в первую очередь эстрона, приводит к гиперсенсибилизации гонадотрофов по отношению к люлиберину (ГнРГ). Одновременно под действием эстрона увеличивается продукция гипоталамусом ГнРГ, повышается амплитуда и частота импульсов его секреции, в результате чего увеличивается продукция аденогипофизом ЛГ, нарушается соотношение ЛГ/ФСГ, возникает относительная недостаточность ФСГ . Усиление влияния ЛГ на яичники способствует повышению продукции андрогенов текальными клетками и их гиперплазии. Относительно низкий уровень ФСГ приводит к снижению активности ФСГ-зависимой ароматазы, и клетки гранулезы теряют способность ароматазировать андрогены в эстрогены. Гиперандрогения препятствует нормальному росту фолликулов и способствует формированию их кистозной атрезии. Отсутствие роста и созревания фолликулов еще более ингибирует секрецию ФСГ. Возросший пул андрогенов в периферических тканях конвертируется в эстрон. Замыкается порочный круг.
Таким образом результатом нарушения центральных и периферических механизмов регуляции стероидогенеза является развитие у больных с СПЯ функциональной овариальной гиперандрогении.
Патогенез СПЯ по S.S.C. Yen представлен на схеме 1:
Схема 1.
В начале 80-х годов ряд авторов предложили новую теорию патогенеза синдрома поликистозных яичников, отличную от теории S.S.C. Yen . Было обнаружено, что СПЯ связан с гиперинсулинемией, и этому синдрому свойственны как нарушение репродуктивной функции, так и метаболических процессов.
На наличие взаимосвязи между гиперинсулинемией и гиперандрогенией указывали еще в 1921 году Achard and Thieris . Они описали гиперандрогению у женщины, страдавшей ожирением и сахарным диабетом 2-го типа и назвали это состояние “диабет бородатых женщин”.
В дальнейшем Д. Барген обнаружил, что у женщин с СПЯ и гиперандрогенией отмечалась базальная и глюкозостимулированная гиперинсулинемия по сравнению с контрольной группой женщин одинакового веса, что предполагало наличие инсулинорезистентности. Выявилась прямая зависимость между уровнями инсулина и андрогенов, и было высказано предположение, что причиной гиперандрогении может быть гиперинсулинемия.
В 1988 году G. Reaven впервые высказал предположение о том, что ИР и компенсаторная гиперинсулинемия (ГИ) играют основную роль в развитии синдрома метаболических нарушений. Он назвал его “синдромом Х” . В настоящее время наиболее часто употребляют термин “метаболический синдром” или “синдром инсулинорезистентности” .
Гипотезы патогенеза гиперинсулинемии и гиперандрогении
Механизм возникновения гиперандрогении и гиперинсулинемии окончательно не изучен. Теоретически возможны три варианта взаимодействия: гиперандрогения (ГА) вызывает ГИ; ГИ приводит к ГА: имеется какой-то третий фактор, ответственный за оба феномена .
1. Предположение о том, что ГА вызывает ГИ основано на следующих фактах. У женщин, которые принимают оральные контрацептивы, содержащие прогестины с “андрогенными свойствами”, выявляется нарушение толерантности к глюкозе. Длительное назначение тестостерона транссексуалам сопровождается возникновением ИР . Показано, что андрогены влияют на состав мышечной ткани, увеличивая количество мышечных волокон второго типа, менее чувствительных к инсулину по сравнению с волокнами первого типа .
2. Большинство факторов свидетельствуют в пользу того, что ГИ приводит к ГА. Было показано, что ИР сохраняется у пациенток, подвергшихся субтотальному или тотальному удалению яичников, а также у женщин, длительно применявших агонисты-ГнРГ, когда отмечалась выраженная супрессия уровня андрогенов . Назначение диазоксида - препарата, подавляющего выделение инсулина поджелудочной железой, вызвало снижение уровня тестостерона (Т) и повышение уровня сексстероидсвязывающего глобулина (СССГ) у пациенток с СПЯ, ожирением и гиперинсулинемией. Внутривенное введение инсулина женщинам с СПЯ приводило к повышению уровня циркулирующих андростендиона и Т. Мероприятия, направленные на повышение чувствительности к инсулину (снижение веса, голодание и низкокалорийная диета), сопровождались понижением уровня андрогенов . Есть данные, что инсулин напрямую может подавлять продукцию СССГ печенью, а в условиях гиперинсулинемии этот эффект усиливается. При этом полагают, что инсулин, а не половые гормоны, является основным регулятором синтеза СССГ. Понижение уровня СССГ приводит к возрастанию концентрации свободного и, следовательно, биологически активного Т (в норме 98% Т находится в связанном состоянии) .
Гипотеза, связывающая ГА с гиперинсулинемией, не дает ответа на вопрос, каким образом яичник сохраняет чувствительность к инсулину при инсулинорезистентном состоянии организма. Было предложено несколько возможных объяснений. Так как инсулин обладает множеством функций, можно предположить селективный дефект некоторых из них. Может наблюдаться органоспецифичность чувствительности к инсулину. Но более вероятно предположение о том, что инсулин действует на яичник не только через рецепторы инсулина, но также через рецепторы инсулиноподобных факторов роста (ИФР) .
Инсулиновые рецепторы и рецепторы ИФР-1 были идентифицированы в яичниках человека (в стромальной ткани яичников здоровых женщин, женщин с СПЯ, в фолликулярной ткани и клетках гранулезы) . Инсулин может связываться с рецепторами ИФР-1, хотя с меньшим сродством, чем с собственными рецепторами. Однако при ГИ, а также в ситуации, когда рецепторы инсулина блокированы или имеется их дефицит, можно ожидать, что инсулин будет связываться с рецепторами ИФР-1 в большей степени .
Возможно, механизмы стимуляции инсулином/ИФР-1 стероидогенеза в яичнике могут быть разделены на неспецифические и специфические. Неспецифические заключаются в классическом действии инсулина на метаболизм глюкозы, аминокислот и синтез ДНК. В результате повышается жизнеспособность клетки и, следовательно, усиливается синтез гормонов . Специфические механизмы включают прямое действие инсулина/ИФР-1 на стероидогенные ферменты, синергизм между инсулином и ЛГ/ФСГ и влияние на количество рецепторов к ЛГ .
Инсулин/ИФР-1, действуя синергично с ФСГ, стимулируют ароматазную активность в культуре клеток гранулезы и тем самым увеличивают синтез эстрадиола. Кроме того, они приводят к повышению концентрации рецепторов ЛГ, усиливая ЛГ-зависимый синтез андростендиона тека- и стромальными клетками.
Возрастающая концентрация андрогенов в яичнике под действием инсулина/ИФР-1 вызывает атрезию фолликулов, что приводит к постепенной элиминации эстроген- и прогестеронпродуцирующих клеток гранулезы, с последующей гиперплазией текальных клеток и лютеинизацией межуточной ткани яичника, которые являются местом продукции андрогенов. Этим объясняется тот факт, что стимуляция яичникового стероидогенеза инсулином проявляется преимущественно в виде гиперандрогении.
Было высказано предположение, что инсулин/ИФР-1 могут стимулировать как ЛГ-зависимую активность цитохрома Р450с17a в яичниках, так и АКТГ-зависимую активность Р450с17a в надпочечниках. Этим, по-видимому, объясняется частое сочетание яичниковой и надпочечниковой форм гиперандрогении у пациенток с СПЯ.
Возможна также взаимосвязь с теорией S.S.C. Yen об участии надпочечникового стероидогенеза в патогенезе СПЯ (схема 2).

Схема 2. Действие инсулина при синдроме поликистозных яичников
V. Insler (1993), проведя исследование уровней инсулина, ИФР-1, гормона роста и их корреляции с уровнями гонадотропинов и андрогенов у женщин с СПЯ, предложил две модели развития данного синдрома. У пациенток с ожирением ГИ вызывает избыточную продукцию андрогенов через рецепторы ИФР-1, которые, действуя в синергизме с ЛГ, вызывают повышение активности цитохрома Р450с17a, основного контролирующего фермента в синтезе андрогенов. У пациенток с нормальной массой тела относительное повышение концентрации гормона роста стимулирует избыточную продукцию ИФР-1. С этого момента синергизм с ЛГ приводит к гиперпродукции андрогенов по тому механизму, что и у пациенток с ожирением. Повышение уровня андрогенов вызывает изменение функции гипоталамических центров, приводя к нарушению секреции гонадотропинов и типичным для СПЯ изменениям (схема 3).
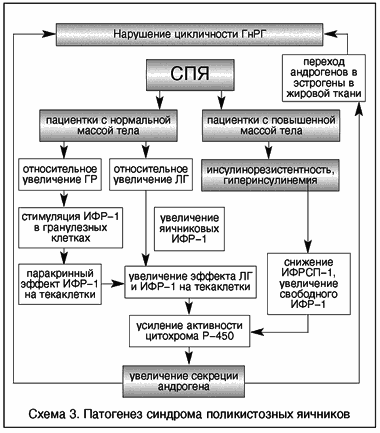
Схема 3. Патогенез синдрома поликистозных яичников
3. Однако имеется ряд хорошо известных состояний ИР, которые не связаны с ГА, например, простое ожирение и СД 2 типа . Для объяснения, почему не у всех пациенток с ожирением и ГИ развивается гиперандрогения и СПЯ, выдвинута гипотеза о существовании генетической предрасположенности к стимулирующему действию инсулина на синтез андрогенов в яичнике . Очевидно, существует ген или группа генов, которые делают яичники женщины с СПЯ более чувствительными к стимуляции инсулином продукции андрогенов .Молекулярные механизмы, приводящие к развитию инсулинорезистентности, до конца не изучены. Однако последние достижения в области молекулярной биологии позволили определить структуру гена, кодирующего рецептор к инсулину у женщин с овариальной гиперандрогенией.
Moller и Flier изучали последовательность аминокислот в структуре ДНК-цепей у больных с овариальной гиперандрогенией. Они обнаружили замещение триптофана на серозин в кодоне 1200. Исследователи предположили, что такое изменение нарушает процесс активации тирозин-киназной системы в рецепторе к инсулину. Низкая активность инсулиновых рецепторов приводит к развитию ИР и компенсаторной ГИ.
Yoshimasa et al. описали другой вариант точечной мутации у больной с гиперандрогенией, инсулинорезистентностью и черным акантозом. Они обнаружили замещение серина на аргинин в тетрамерной структуре инсулинового рецептора. Данная мутация в активном локусе приводила к невозможности соединения a- и b-субъединиц, в результате чего функционально активный рецептор не синтезировался. Приведенные исследования - лишь первые попытки выявления специфической генетической этиологии стромального текоматоза яичников.
Позднее Dunaif A. отмечает, что при синдроме поликистозных яичников ИР может быть обусловлена нарушением аутофосфорилирования b-субъединиц инсулинового рецептора (иР), цитоплазматическая часть которых обладает тирозинкиназной активностью. При этом повышается инсулиннезависимое фосфорилирование остатков серина (СПЯ-ser) с подавлением активности тирозинкиназы (вторичный передатчик сигнала, определяющий чувствительность инсулина к одноименным рецепторам). Данный дефект характерен только для СПЯ-зависимой ИР, при других инсулинорезистентных состояниях (ожирение, ИНСД) эти изменения не выявляются .
Нельзя исключить, что при СПЯ-ser существует некий серинфосфорилирующий фактор. Так, например, выделяют ингибитор серин/треонинфосфатазы, который, по-видимому, и нарушает фосфорилирование иР при СПЯ-ser. Данное соединение схоже с недавно выделенным мембранным гликопротеидом РС-1 (ингибитор тирозинкиназы инсулинового рецептора), но последний не увеличивает инсулиннезависимое фосфорилирование серина иР.
Подобными свойствами обладает и фактор некроза опухоли-a (ФНО-a): фосфорилирование остатков серина IRS-1 (один из вторичных передатчиков сигнала иР) под влиянием ФНО-a влечет за собой подавление тирозинкиназной активности иР.
Moller et al. обнаружили, что фосфорилирование серина Р450с17 человека, ключевого фермента, регулирующего биосинтез надпочечниковых и овариальных андрогенов, повышает 17,20-лиазную активность. Модулирование энзимной активности стероидогенеза за счет фосфорилирования серина было описано для 17b-гидроксистероиддегидрогеназы. Если предположить, что один и тот же фактор (энзим) фосфорилирует серин инсулинового рецептора, вызывая ИР, и серин Р450с17, вызывая гиперандрогению, то тогда можно объяснить взаимосвязь СПЯ и ИР. В экспериментах in vitro было показано, что протеинкиназа А (серин/треонинкиназа) катализирует фосфорилирование серина инсулиновых рецепторов (схема 4).

Схема 4. Ген инсулинорезистентности при СПЯ
Роль лептина при СПЯВ последнее время проводился ряд исследований, посвященных биологической роли лептина, результаты которых обнадеживают. Являясь протеиновым гормоном, лептин влияет на пищевое поведение и оказывает пермиссивное действие в отношении инициации полового созревания у животных. Роль данного гормона в регуляции метаболизма и репродуктивной функции у человека, к сожалению, окончательно не выяснена. По этой причине данные об уровне лептина при овариальной гиперандрогении в сочетании с инсулинорезистентностью и представления о его роли в развитии этих изменений весьма противоречивы.
В последнее время проводился ряд исследований, посвященных биологической роли лептина, результаты которых обнадеживают. Являясь протеиновым гормоном, лептин влияет на пищевое поведение и оказывает пермиссивное действие в отношении инициации полового созревания у животных. Роль данного гормона в регуляции метаболизма и репродуктивной функции у человека, к сожалению, окончательно не выяснена. По этой причине данные об уровне лептина при овариальной гиперандрогении в сочетании с инсулинорезистентностью и представления о его роли в развитии этих изменений весьма противоречивы.Так, согласно результатам исследования, проведенного Brzechffa et al. (1996), значительная часть женщин в популяции с СПЯ имеет уровень лептина выше, чем ожидалось с учетом их ИМТ, свободного тестостерона, чувствительности к инсулину. С другой стороны, последние работы в этой области не показали существенных различий уровней лептина в исследуемых группах при СПЯ и в группах контроля. Кроме того, было установлено, что на содержание лептина не оказывают влияние базальный уровень инсулина, содержание гонадотропинов и половых стероидов. Однако Zachow и Magffin (1997), принимая во внимание данные о наличии мРНК рецепторов лептина в овариальной ткани, продемонстрировали прямое действие указанного гормона на стероидогенез клеток гранулезы крыс in vitro. При этом было показано дозозависимое подавляющее действие лептина на ИФР-1, потенцированное увеличением ФСГ-стимулированного синтеза Е 2 клетками гранулезы. Эти данные подтверждают гипотезу о том, что повышение уровня лептина у лиц с ожирением может противодействовать созреванию доминантного фолликула и овуляции. Весьма интересными являются данные Spicer и Franciso (1997), свидетельствующие о том, что лептин в нарастающих концентрациях (10-300 нг/мл) ингибирует инсулинзависимую продукцию Е 2 и прогестерона в культуре клеток гранулезы. Этот эффект обусловлен наличием специфических сайтов связывания для лептина. По аналогии с этим можно предположить, что высокий уровень лептина может снижать чувствительность у других тканей-мишеней к действию эндогенного инсулина, приводя к развитию ИР при ожирении.
Диагноз
Диагностика синдрома овариальной гиперандрогении при типичной клинической картине не представляет трудностей. Прежде всего это нарушение менструальной функции по типу олиго-, опсо- или аменореи, ановуляция и обусловленное ею первичное или вторичное бесплодие, гирсутизм, угревая сыпь, у 40% больных имеется ожирение различной степени выраженности. При гинекологическом осмотре выявляется двухстороннее увеличение размеров яичников, нередко на фоне гипопластичной матки.
Важное место в диагностике СПЯ занимают гормональные методы исследования , направленные на выявление гиперандрогении, ее источника и определение уровня гонадотропных гормонов: ЛГ и ФСГ. У больных с СПЯ часто встречается преобладание уровня ЛГ над ФСГ, соотношение их нарушено и увеличено (больше 2,5-3). Уровень пролактина нормальный, хотя у 30% больных наблюдается его некоторое повышение.
Уровень экскреции с мочой суммарных 17-КС при СПЯ колеблется в широких пределах и мало информативен. Определение фракций 17-КС (ДГА, 11-окисленных кетостероидов, андростерона, этиохоланолона) также не обеспечивает выявление локализации источника гиперандрогении . Подтверждением овариального источника гиперандрогении является повышение уровня андростендиона (А) и тестостерона (Т) крови и повышение соотношения А/Т. Надпочечниковый генез гиперандрогении подтверждается при повышении уровня дегидроэпиандростерона (ДГА) и его сульфата (ДГА-С) и 17-оксипрогестерона (17-ОН-Р) в крови. Для уточнения локализации источника гиперандрогении предложены различные функциональные тесты, наибольшее распространение из которых получили проба с дексаметазоном, синактеном-депо.
С учетом открытия новых патогенетических звеньев в развитии СПЯ для оценки состояния углеводного обмена необходимо проводить стандартный глюкозо-толерантный тест (75 мл глюкозы per os) с определением уровня глюкозы и иммуно-реактивного инсулина (ИРИ). Свидетельством в пользу инсулинорезистентности являются также ИМТ более 25 и ОТ/ОБ больше 0,85, а также дислипидемия.
Лечение
В основе современного подхода к патогенетическому лечению СПЯ лежит принцип восстановления нарушенной функции яичников
, то есть устранение ановуляции, что в свою очередь приводит к снижению гиперандрогении и восстановлению фоликулогенеза. Однако изучение особенностей этиопатогенеза овариальной гиперандрогении приводит к заключению, что выбор методов адекватного лечения СПЯ оказывается непростой задачей.
Комбинированные оральные контрацептивы - наиболее часто используемая при СПЯ группа препаратов. Механизм действия заключается в подавлении повышенного ЛГ, нормализации соотношения ЛГ/ФСГ, повышении синтеза печенью СССГ. После отмены достигается “ребаунд-эффект”, заключающийся в нормализации гипоталамо-гипофизарной функции, снижении гиперпродукции андрогенов овариальной тканью, нормализации фолликулогенеза и восстановлении овуляции.
Лечение проводится по стандартной схеме: по 1 таблетке в день с 5 по 25 день цикла в течение 3-6 месяцев. При необходимости курсы повторяют. Однако известно, что длительный прием эстроген-гестагенных контрацептивов может привести к гиперинсулинемии, усугубляя тем самым основное патогенетическое звено СПЯ.
Некоторые контрацептивы имеют в своем составе гестагенные компоненты производные 19-норстероидов (норэтистерон, левоноргестрел), обладающих в разной степени андрогенными эффектами, в связи с чем назначение препаратов, содержащих эти компоненты, у больных с гирсутизмом ограничено. Более целесообразно при симптомах гиперандрогении использовать оральные контрацептивы с гестагеном без андрогенного действия.
Возможно применение гестагенных препаратов, лишенных андрогенных свойств в виде монотерапии, особенно при гиперплазии эндометрия. Дидрогестерон назначают по 1 таблетке (10 мг) 2 раза в день с 14-16 по 25 день цикла продолжительностью от 3 до 6 курсов.
Наиболее эффективным средством стимуляции овуляции при СПЯ является антиэстрогенный препарат кломифенцитрат . Основными эффектами антиэстрогенов являются снижение гиперсенсибилизации гипофиза к действию ГнРГ, снижение продукции ЛГ, индукция овуляторного выброса ЛГ, стимуляция овуляции. Препарат назначается по 50 мг, 100 мг в сутки с 5 по 9 день цикла до достижения овуляции по тестам функциональной диагностики, но не более 3-х курсов подряд. В последнее время появились публикации о влиянии кломифенцитрата на систему инсулин-инсулиноподобный фактор роста. В них указывалось, что к 5 дню проводимой стимуляции овуляции кломифеном (150 мг/сут) определялось прогрессивное снижение (максимально на 30%) уровня ИФР-1. Однако в ряде других аналогичных исследований достоверного снижения базального уровня инсулина в ответ на введение кломифена не было обнаружено.
Появление препаратов с антиандрогенными свойствами значительно расширило терапевтические возможности при СПЯ. Наиболее широко применяется препарат Диане-35, содержащий 35 мг этинилэстрадиола и 2 мг ципротерона ацетата. Кроме действия, характерного для оральных контрацептивов, препарат блокирует действие андрогенов на уровне клеток-мишеней, в частности, волосяных фолликулов. Последнее приводит к уменьшению гирсутизма. Препарат применяют по стандартной схеме, как оральный контрацептив курсами по 6 и более циклов. Однако нужно отметить наличие отрицательного эффекта этих препаратов на липидный и углеводный обмены, проявляющегося в повышении уровня холестерина, липопротеидов низкой плотности, а также в увеличении гиперинсулинемии, что требует постоянного динамического контроля за этими показателями у пациенток с СПЯ. Антиандрогенными свойствами обладают также спиронолактон, который широко применяется в лечении андрогензависимых дермопатий.
Одним из основных направлений в современной терапии овариальной гиперандрогении является поиск и применение препаратов и средств, направленных на устранение инсулинорезистентности и компенсаторной гиперинсулинемии.
Прежде всего это мероприятия, обеспечивающие снижение избыточной массы тела: низкокалорийная диета (в пределах 1500-2200 ккал/сут) с ограничением жиров и легко усваиваемых углеводов, ограничение потребления соли до 3-5 г в сутки, занятия умеренной физической нагрузкой, нормализация режима труда и отдыха. Возможно применение препаратов, способствующих снижению ИМТ, например, орлистата, селективно угнетающего желудочно-кишечные липазы (“блокатор жира”) или сибутрамина, блокирующего обратный захват норадреналина и серотонина в синапсах гипоталамического центра “насыщения”. Увеличенный расход энергии (термогенез) также обусловлен синергическим взаимодействием между усиленной функцией норадреналина и серотонина в центральной нервной системе. Это выражается в селективной активации центрального симпатического воздействия на бурую жировую ткань за счет непрямой активации b 3 -адренорецепторов.
Следующим этапом является применение препаратов, улучшающих нарушенную чувствительность тканей к действию инсулина. В литературе имеются данные о снижении гиперандрогении и восстановлении менструальной и овуляторной функции при назначении препаратов ряда бигуанидов (метформин /Сиофор®/, “Берлин-Хеми”). Они потенцируют действие инсулина на рецепторном и пострецепторном уровне и значительно улучшают чувствительность тканей к данному гормону. В некоторых исследованиях показано значительное снижение уровня инсулина натощак и через 2 часа после нагрузки 75 г глюкозы у женщин с СПЯ, применявших метформин. Это снижение коррелировало со снижением уровня андрогенов. Необходимо отметить также, что применение бигуанидов, нормализующих углеводные нарушения, нередко приводит к снижению ИМТ у пациенток с ожирением и положительно влияет на липидный обмен.
В мировой литературе сообщаются результаты применения препаратов, относящихся к классу тиазолидиндионов. Исследования показали, что на фоне лечения троглитазоном (200-400 мг/сут) улучшается чувствительность к инсулину у женщин с СПЯ, снижается уровень андрогенов. Однако выявленное цитотоксическое, гепатотоксическое действие этой группы препаратов ограничивает возможность их широкого применения. Ведется поиск новых препаратов, избирательно влияющих на чувствительность к инсулину.
Несмотря на значительный арсенал различных средств, применяемых для лечения овариальной гиперандрогении, терапия данной патологии должна быть комплексной и последовательной, учитывающей ведущее патогенетическое звено на данном этапе лечения.
Лечение женщин с СПЯ должно быть направлено не только на коррекцию выявленных симптомов этого заболевания, но и на профилактику возможных будущих осложнений. Очень важным является подавление избыточной секреции андрогенов и индуцирование стабильности ежемесячных менструальных кровотечений, что радежно достигается при применении препаратов с антиандрогенными свойствами (Диане-35).
В случае неэффективности консервативной терапии через год можно ставить вопрос об оперативном лечении - лапароскопии с клиновидной резекцией яичников или их лазерной вапоризацией . Эффективность хирургического лечения высокая (до 90-95% восстановления овуляции), а предварительная патогенетическая терапия повышает стабильность достигнутого результата.
Литература:1. Овсянникова Т.В., Демидова И.Ю., Глазкова О.И. Проблемы репродукции, 1998; 6: 5-8.
2. Гинзбург М.М., Козупица Г.С. Проблемы эндокринологии, 1997; 6: 40-2.
3. Старкова Н.Т. Клиническая эндокринология. Руководство для врачей, 1991; 399.
4. Givens J.R., Wiedeme E. B-endorphine and B-lipotropin levels in hirsute women: correlation with body weight. J Clin Endocr Metabol. 1980; 50: 975-81.
5. Aleem F.A., McIntosh T. Elevated plasma levels of f-endorph in a group of women with polycystic ovarian desease. Fertil and Steril. 1984; 42: 686-9.
6. Дедов И.И., Сунцов Ю.И., Кудрякова С.В. Проблемы эндокринологии. 1998; 6: 45-8.
7. Francis S., Greenspan, Forshman P.H. Basic and clinical endocrinology. 1987.
8. Акмаев И.К. Проблемы эндокринологии. 1990; 12-8.
9. Barbieri R.L., Hornstein M.D. Hyperinsulinemia and ovarian hyperandrogenism: cause and effect. Endocrinol Metab Clin North Am. 1988; 17: 685-97.
10. Barbieri R.L., Macris A., Ryan K.J. Insulin stimulates androgen accumulation in incubation of human ovarian stroma and theca. Obstet Gynecol. 1984; 64: 73-80.
11. Barbieri R.L., Ryan K.J. Hyperandrogenism, insulin resistence, acantosis nigricans: a common endocrinopathy with unique pathophysiologic features. Am J Obstet Gynecol. 1983; 147: 90-103.
12. Barbieri R.L., Smith S., Ryan K.J. The role of Hyperinsulinemia in the pathogenesis of ovarian Hyperandrogenism. Fertil and Steril. 1988; 50: 197-210.
13. Stuart C.A., Prince M.J., Peters E.J. Obstet Gynecol. 1987; 69: 921-3.
14. Yen S.S.C. Chronic anovuletion causet by peripheral endocrine disorders. In: Yen S.S.C., Jaffe R.B. Reproductive endocrinology: physiology, pathophysiology, and clinical managment. Philadelphia: Saunders W.B. 1986; 462-87.
15. Moller D.E., Flier J.S. Detection of an alteration in the insulin-reseptor gene in a patient with insulin resistance, acantosis nigricans and polycystic ovarian syndrome. N Engl J Med. 1988; 319: 1526-32.
16. Burgen G.A., Givens J.R. Insulin resistance and hyperandrogenism: clinical syndromes and possible mechanisms. Hemisphera Pablishing CO, Washington, DC. 1988; 293-317.
17. Speroff L., Glass R. H. Clinical gynecologic. Endocrinology and Infertiliti 5 th ed. 1994.
18. Yoshimasa Y., Seino S., et al. Insulin resistance diabetes due to a point mutacion that privents insulin proreceptor processing./ Science. 1988; 240: 784-9.
19. Dunaif A. Endocrin. Rev., 18(6): 1997; 12: 774-800.
Этинилэстрадиол + ципротерона ацетат
Диане-35 (торговое название)
(Shering AG)
– это патологическое состояние, которое связано с чрезмерной выработкой мужских половых гормонов. Синдром проявляется изменением менструальной функции, бесплодием, нарушением обмена веществ, дерматологическими симптомами. Заболевание обычно вызвано нарушениями в репродуктивной и эндокринной системах, в том числе опухолями.
Особенности патологии
Под термином «гиперандрогения у женщин» специалисты объединяют патологические состояния, имеющие различное происхождение и приводящие к повышению концентрации мужских гормонов в крови или увеличению восприимчивости к этим веществам у тканей-мишеней. Этот синдром широко распространен среди женщин репродуктивного возраста. Он выявляется примерно у 5–7% подростков и 10–20% взрослых старше 25 лет.
При гиперандрогении у женщин начинают расти волоски там, где их не должно быть
К андрогенам относятся мужские половые гормоны, имеющие стероидную природу:
- тестостерон;
- дигидротестостерон;
- ДГЭА-С.
В норме у женщин эти вещества синтезируются клетками яичников и надпочечников. Небольшое количество таких гормонов также синтезируется жировой клетчаткой. Регуляция этого процесса осуществляется гипофизом посредством лютеинизирующего и адренокортикотропного гормонов (ЛГ и АКТГ).
От уровня андрогенов в организме у женщины зависит выраженность либидо. Во время полового созревания эти гормоны способствуют росту девочки за счет увеличения длины трубчатых костей, участвуют в формировании оволосения по женскому типу. В тех случаях, когда содержание андрогенов в крови становится слишком высоким, развиваются заболевания эндокринной и репродуктивной систем.
Это проявляется не только нарушениями косметического характера в виде акне, себореи, изменения оволосения, выпадения волос, но и значительным изменением обмена веществ. Нарушаются метаболизм углеводов и жиров, процесс формирования яйцеклеток в яичниках, менструальный цикл.
В запущенных случаях гиперандрогении развивается бесплодие.
Длительная гиперандрогения может способствовать возникновению рака шейки матки, увеличению объема эндометрия, заболеваний сердца и сосудов, сахарного диабета второго типа. Если такое состояние возникает при беременности, то в большинстве случаев происходит выкидыш.
Классификация гиперандрогении у женщин
Данный синдром по источнику возникновения может быть яичниковым или надпочечниковым – в медицинской литературе эти заболевания обозначаются терминами "овариальная" и "адреналовая" гиперандрогения. Также синдром может носить первичный или вторичный характер, то есть развиваться на фоне полного здоровья или быть следствием какой-либо патологии. В некоторых случаях в возникновении патологии играет роль наследственный фактор.
Гиперандрогения также подразделяется на следующие формы:
- абсолютная;
- относительная.
Первая связана с повышением выработки мужских половых гормонов и увеличением их концентрации в крови пациентки. Вторая – с усилением восприимчивости тканей-мишеней к действию этих биологически активных веществ. Относительная форма заболевания встречается чаще.
Причины гиперандрогении
Усиление выработки мужских половых гормонов обычно наблюдается при заболеваниях репродуктивной и эндокринной систем. Привести к развитию такого состояния могут следующие патологии.
- Поликистоз яичников , который может быть первичным или вторичным. Во втором случае заболеванию чаще предшествуют гипотиреоз, гиперпролактинемия, патология гипоталамуса.
- Врожденная гиперплазия надпочечников , или адреногенитальный синдром. В этом случае синтез андрогенов усиливается вследствие повышения уровня АКТГ.
- Галакторея -аменорея – это патологическое состояние сопровождается увеличение концентрации пролактина в крови женщины, который также стимулирует выработку стероидов.
- Вирилизирующие опухоли яичников и надпочечников . К этой группе онкологических заболеваний относятся текома, андростерома, лютеома.
- Стромальный текоматоз яичников – доброкачественная патология, связанная с увеличением объема овариальной стромы.
Транспортная форма гиперандрогении развивается при недостаточной активности белков, которые связывают стероидные гормоны. Это приводит к недостаточному блокированию свободного тестостерона и, как следствие, чрезмерному влиянию этого вещества на клетки-мишени. Такое состояние может развиваться при синдроме Иценко-Кушинга, дислипидемии, гипотиреозе.
У ¾ пациенток с акне не отмечается превышения нормы концентрации мужских половых гормонов в крови. Чрезмерная активность сальных желез в этих случаях связана с увеличением количества и восприимчивости рецепторов к андрогенам в коже.
Выработка жира регулируется дигидротестостероном, который также оказывает влияние на состав и свойства секрета. Поэтому изменение чувствительности к этому гормону приводит к образованию комедонов, возникновению акне.
Причины оволосения по мужскому типу в большинстве случаев связаны с высоким содержанием андрогенов в крови пациентки. Только у 20–30% женщин этот синдром возникает при чрезмерном образовании дигидротестостерона, который стимулирует рост волос на чувствительных к андрогенам участках тела и выпадению их на голове. В некоторых случаях такое состояние развивается при неконтролируемом приеме гормонсодержащих препаратов.
Симптомы гиперандрогении
Клиническая картина заболевания определяется тем, насколько изменен гормональный фон женщины, а также зависит от причины патологии. Например, если заболевание не вызвано опухолью репродуктивной системы, симптоматика прогрессирует очень медленно, длительность болезни может достигать нескольких лет.
Первые симптомы появляются в период полового созревания – акне, себорея, изменение менструального цикла вплоть до полного отсутствия месячных, усиленный рост волос на ногах, руках и лице. Постепенно в яичниках могут образовываться кисты, что становится причиной невозможности овуляции, снижения активности прогестерона, нарушения фертильности и бесплодия. В позднем возрасте, после наступления менопаузы, могут начать выпадать волосы на висках, затем на теменной области.
Перечисленные выше симптомы, включающие изменение внешнего вида и невозможность забеременеть, нередко приводят к развитию неврозов и депрессий у пациенток.
При адреногенитальном синдроме заболевание проявляется намного ярче. Клиническая картина в этом случае характеризуется общей маскулинизацией, поздним появлением месячных, вирилизацией половых органов. Также практически всегда отмечаются гирсутизм, акне и другие дерматологические явления.
Из-за высокого уровня андрогенов в крови развивается метаболический синдром, который при отсутствии терапии способствует возникновению сахарного диабета II типа. Вместе с этим отмечается стойкая артериальная гипертензия, ишемия миокарда и другие кардиологические нарушения. Как правило, при наличии патологии надпочечников симптоматика прогрессирует очень быстро.
Диагностика гиперандрогении
Поставить предварительный диагноз можно на основании данных общего осмотра пациентки, анамнеза заболевания. Важную роль в этом играют симптомы, связанные с нарушением менструального цикла, изменение оволосения, дерматологические проявления.

Перед тем как назначить лечение от гиперандрогении, проверяют уровень гормонов в крови
Для постановки окончательного диагноза необходимо проведение лабораторных исследований с целью определения уровня общего и свободного тестостерона, дигидротестостерона и других андрогенов. Если отмечается повышение количества ДГЭА-С, следует заподозрить наличие адреналовой гиперандрогении. Значительное увеличение уровня этого гормона вместе с высокой концентрацией тестостерона часто свидетельствует о наличии опухоли надпочечников, что требует проведения УЗИ, КТ или МРТ.
Вместе с этим проводится исследование для определения уровня:
- пролактина, лютеинизирующего гормона, ФСГ;
- кортизола, 17-КС и других гормонов надпочечников;
- глюкозы крови, гликированного гемоглобина, инсулина;
- проведение глюкозотолерантного теста;
- холестерина.
Всем пациенткам также показана консультация эндокринолога и дерматолога.
Лечение гиперандрогении
Терапия заболевания проводится длительно – курсами до года и более. Врач подбирает лечение, исходя из данных обследования и диагностированной патологии. Для этого используются медикаменты, регулирующие гормональный фон женщины, – оральные контрацептивы, снижающие концентрацию андрогенов в крови. Такие лекарства снижают активность синтеза гонадотропинов, тормозят овуляцию и подавляют выработку стероидных гормонов, тестостерона. Дополнительно оральные контрацептивы блокируют андрогеновые рецепторы в тканях-мишенях.
Самостоятельное лечение при таком заболевании недопустимо, т. к. может вызвать еще большие проблемы в репродуктивной системе женщины.
Лечение заболевания, связанного с нарушением деятельности надпочечников, требует использования кортикостероидов. Также такие лекарства применяют при выявлении гиперандрогении при беременности или во время подготовки к гестации. Дополнительно необходимо проводить терапию сопутствующей эндокринной патологии.
Гиперандрогения – это тяжелое состояние, которое при отсутствии лечения может привести к бесплодию. Диагностику и терапию патологии проводит врач-гинеколог вместе с эндокринологом. Только после прохождения полного обследования, включающего в себя определение уровня половых гормонов в крови пациентки, можно подобрать схему терапии.
Синдром гиперандрогении – это целая группа патологий, которые объединяет повышение количества или активности андрогенов в организме женщин. Наблюдается, в основном, в подростковом и детородном возрасте, возникает по разным причинам. Наиболее распространенная – поликистоз яичников, также встречается надпочечниковая гиперандрогения, врожденная, идиопатическая, связанная с опухолями гипофиза или яичников. Проявляется гирсутизмом (излишним ростом волос по мужскому типу), гиперфункцией сальных желез, абдоминальным ожирением, андрогенным облысением, в тяжелых случаях атрофией молочных желез, матки, яичников. Лечение синдрома гиперандрогении зависит от эго этиологии, степени проявлений, может быть консервативным или оперативным.
Гиперандрогения у женщин - причины
Гиперадрогения у женщин, симптомы ее, могут быть проявлениями следующих заболеваний:
- Синдром поликистоза яичников
- Гирсутизм идиопатичесий
- Надпочечниковая гиперандрогения врожденная
- Текоматоз стромы яичников
- Опухоли с гиперпродукцией андрогенов
- Другие причины
Самой частой причиной синдрома гиперандрогении является СПКЯ (синдром поликистозных яичников). Он бывает первичным (синдром Штейна-Левенталя), или вторичным, который развивается на фоне гипоталамического синдрома, гиперпролактинемии, первичного гипотериоза. При этом у женщин повышается в крови уровень цитохрома Р, который стимулирует продукцию андрогенов в надпочечниках. Параллельно увеличивается резистентность тканей к инсулину, повышается его продукция в поджелудочной железе и уровень в крови. Это ведет к нарушению обмена глюкозы, жиров, пуринов. Повышение синтеза андрогенов характерно для опухолей яичников, гипоталамуса, гипофиза.
Кроме вышеперечисленных механизмов в возникновении при гиперандрогении симптомов имеет значение изменение активности андрогенов. Оно может быть связано с недостаточным связыванием тестостерона с белками плазмы или же снижением количества этих белков. Такое состояние характерно для гипотиреоза и недостатка андрогенов. При идиопатическом гирсутизме возрастает скорость их превращения в тестостерон и дегидротестостерон, некоторые ткани становятся более чувствительными к их воздействию. Потому при гиперандрогении лечение необходимо даже тогда, когда уровень тестостерона в крови не повышен.
Признаки гиперандрогении
В первую очередь андрогены воздействуют на сальные железы, волосяные фолликулы, что приводит к возникновению себореи, гирсутизма, облысения. Также мишенями их становятся половые органы. Влияют андрогены и на жировой обмен, рост мышечной ткани, систему крови. Они стимулируют эритропоэз, повышают свертываемость крови, увеличивают риск образования тромбов, в том числе и в коронарных сосудах. Когда возникает гиперандрогения у женщин: причины ее могут быть разными, но клинические проявления всегда схожи.
Гиперандрогения у женщин симптомы имеет трех типов:
- Первое – это дерматологические проявления, которые могут долгое время оставаться единственным клиническим признаком гормональных нарушений.
- Вторая группа – изменения вторичных половых признаков.
- К третьей группе относятся симптомы, связанные с третичными половыми признаками, изменениями в органах и системах, не связанных напрямую с половой сферой.
Наиболее чувствительными к воздействию андрогенов являются сальные железы, которые начинают под влиянием гормонов выделять повышенное количество кожного сала. Потому гиперандрогения симптомы имеет такие, как себорея, угри, жирный блеск кожи. Грибковое поражение кожных покровов головы ведет к возникновению перхоти. Закупорка сальных желез на лице – главная причина акне, а вследствие их воспаления появляются прыщи.
Воздействие андрогенов на волосяные фолилкулы является причиной гирсутизма и андрогенного облысения. Более всего чувствительны к гормональным влияниям волосы в лобковой части, на внутренней стороне бедер, на животе и лице. Под воздействием тестостерона и дегидротестостерона они превращаются из пушковых в жесткие, потому что период покоя волосяных фолликулов резко сокращается. На голове (в височной и теменной части) наоборот, тестостерон вызывает удлинение периода покоя. Из-за чего происходит истончение волосков, замедление их роста и усиленное выпадения. Часто гиперандрогения у женщин симптомы имеет исключительно со стороны кожи, при этом уровень андрогенов в крови нормальный. Связано это с высокой активностью 5α-редуктазы, которая превращает тестостерон в дегидротестостерон.
Гиперандрогения симптомы может иметь и со стороны половых органов. В основном они связаны с абсолютным повышением в крови андрогенов. Проявляются инволюцией молочных желез, уменьшением размеров матки и яичников, увеличением размера клитора, огрубением голоса. Часто сопровождается снижением полового влечения, признаками депрессии. В дальнейшем у женщин начинает развиваться ожирение по мужскому типу, с акцентом на живот и верхнюю половину тела, гипертрофия мышц. Может повышаться свертываемость крови, количество в ней эритроцитов. Все эти симптомы сочетаются с кожными проявлениями. Чаще всего такие общие признаки гиперандрогении являются клиническими проявлениями синдрома поликистозных яичников либо опухолей.
Надпочечниковая гиперандрогения имеет врожденный наследственный характер. Связана она с дефицитом фермента С21-гидроксилазы в коре надпочечников. Он отвечает за синтез стероидов, при его снижении увеличивается выработка андрогенов. Заболевание может проявляются в разном возрасте. В тяжелых случаях уже при рождении у девочек наблюдается атрофия женских половых органов, что часто затрудняет определение пола. При среднем снижении уровня фермента болезнь начинает прогрессировать в подростковом возрасте. Месячные начинаются поздно, в 15-16 лет, они нерегулярны. Грудные железы развиты слабо, наблюдается гирсутизм, строение фигуры по мужскому типу, с узкими бедрами и широкими плечами. Рост у девочек небольшой, иногда у них формируются мужские черты лица. Легкая степень надпочечниковой гиперандрогении проявляется в молодом возрасте незначительным гирсутизмом, нерегулярными месячными. Часто она становится причиной бесплодия.
Гиперандорогения у женщин при беременности
Синдром гиперандрогении часто становится причиной бесплодия у женщин. Оно может проявляться как невозможностью зачать ребенка, так и привычным невынашиванием беременности. Яичниковая гиперандрогения может возникать при СПКЯ, это наиболее частая причина повышенной продукции гормонов. В такой ситуации не только наблюдается гормональный дисбаланс, но и ановуляторные циклы у женщин. Фолликул развивается не до конца, и клетка из него не выходит, а значит зачатие невозможно. Надпочечниковая гиперандрогения, лечение которой довольно сложное, может проявляться как отсутствием овуляции, так и выкидышами на разных сроках.
Гиперандрогения у женщин при беременности, если зачатие состоялось, может привести к выкидышу в конце первого триместра и к преждевременным родам в средине второго. Под воздействием мужских гормонов плохо развивается желтое тело или происходит его инволюция. Это ведет к снижению уровня прогестерона, недостаточной пролиферации эндометрия. В результате, эмбрион не может закрепиться в стенке матки и беременность прерывается приблизительно в 10-12 недель.
Когда функцию синтеза гормонов берет на себя плацента, на 18-20 неделе, риск выкидыша уменьшается. Но гиперандрогения при беременности мальчиком может обостриться, так как в это же время надпочечники плода начинают вырабатывать собственные андрогены. Проявлением может стать истмико-цервикальная недостаточность, преждевременное старение плаценты. Если все опасные периоды были пройдены благополучно, особых рисков для будущего ребенка нет. Иногда гиперандрогения при беременности мальчиком может проявиться увеличением мошонки и полового члена после рождения, а у девочек – отеком внешних половых органов. Но явление это временное и быстро проходит.
Синдром гиперандрогении - диагностика
Гиперандрогения у женщин симптомы имеет довольно выраженные, особенно со стороны кожных покровов. Потому первым диагностическим мероприятием будет детальный осмотр. Степень гирсутизма оценивают с помощью индекса Ферримана-Голлвея. Он показывает интенсивность роста волос в области лица, плеч, живота, бедер, спины и ягодиц. В норме должен быть меньше 8, максимальное значение – 36. Признаки гиперандрогении выявляют также при стандартном гинекологическом осмотре, проверяют размеры молочных желез, наличие молозива (характеризирует гиперпролактинемию), оценивают строение тела и тип отложения жира.
Яичниковая гиперандрогения
Характерными симптомами этой формы гиперандрогении являются:
- бесплодие
- нерегулярные менструации вплоть до аменореи;
- гирсутизм (избыточный рост жестких и длинных волос по мужскому типу).
Примерно половина женщин с гиперандрогенией яичникового генеза страдают ожирением, что подтверждает повышенный индекс массы тела (ИМТ) - 26,3±0,8. У них часто отмечаются гиперинсулинемия и инсулинорезистентность, что скорее обусловлено ожирением, а не гиперандрогенией. У таких пациенток нередко развивается диабет, поэтому во время беременности необходим контроль за толерантностью к глюкозе. Нормализация углеводного обмена достигается путем снижения массы тела, при этом понижается и уровень андрогенов.
Методами диагностики яичниковой гиперандрогении являются:
- Гормональное обследование
Результаты гормонального обследования при яичниковой гиперандрогении обнаруживают:
- высокую концентрацию лютеинезирующего гормона (ЛГ),
- высокую концентрацию тестостерона (Т),
- повышение уровня фолликулостимулирующего гормона (ФСГ).
УЗИ-диагностика при яичниковой гиперандрогении выявляет:
- увеличение объема яичников,
- гиперплазию стромы,
- более 10 атретичных фолликулов размером 5-10 мм, расположенных по периферии под утолщенной капсулой.
Надпочечниковая гиперандрогения
Гиперандрогения надпочечникого генеза является ведущим фактором невынашивания у 30% женщин с гиперандрогенией. Причиной гиперандрогении в этом случае чаще всего выступаетадреногенитальный синдром, который проявляется в виде недостатка или отсутствия ферментов-глюкокортикоидов для гормонального синтеза в коре надпочечников. В связи с этим возможно развитие заболевания уже в детском возрасте.
Для диагностики надпочечниковой гиперандрогении в первую очередь производят обследование, которое направлено на определение возможных отклонений от нормы уровня отдельно взятых видов гормонов и гормонального фона в целом. Обязательно применение УЗИ и других специальных методов. В том случае, если пациентка диагностировалась во время беременности, и была выявлена гиперандрогения, то для лечения потребуется назначение лекарственных средств, которые будут способствовать понижению в крови андрогена. Наиболее подходящий и оптимальный способ подбирается в каждом конкретном случае индивидуально. Если схема лечения будет подобрана своевременно и грамотно, зачатие ребенка и роды станут вскоре допустимыми.
Гипперандрогения - лечение
Можно ли вылечить гиперандрогению? Все зависит от ее причины, тяжести симптомов. Правильно выбранная тактика терапии во многих случаях позволяет нивелировать симптомы заболевания, а также решить проблему бесплодия. Надпочечниковая гиперандрогения лечение предусматривает стероидными препаратами. Они подавляют избыточную продукцию в надпочечниках андрогенов. При беременности у женщин с таким синдромом терапию продолжают, как минимум, до окончания первого триместра.
Идиопатическая гиперандрогения у женщин лечение имеет направленное на снижение периферических влияний тестостерона. Она блокирует действие гормона на уровне сальных желез и волосяных фолликулов. Используют блокаторы андрогеновых рецепторов, например, флутамид. Хороший эффект оказывает финастреид, ингибитор фермента 5α-редуктазы. Спиронолактон является не только антагонистом альдостерона, но и отчасти андрогенов. Он уменьшает отеки и снижает активность мужских гормонов. Также гиперандрогении лечение проводят прогестагенами.
Яичниковая гиперандрогения, связанная с поликистозом, лечится путем подавления синтеза андрогенов в этих органах. Используют комбинированные контрацептивы, например, Диане 35. При неэффективности применяют препараты, подавляющие синтез гонадотропных гормонов в гипофизе и гипоталамусе. Если вызвана опухолью гиперандрогения у женщин, лечение проводится хирургическое.
Начните свой путь к счастью - прямо сейчас!
Гиперандрогения – патологическое состояние, которое возникает у девочек и женщин, и характеризуется повышенным уровнем андрогенов в организме. Андроген считается мужским гормоном – в женском организме он тоже присутствует, но в незначительном количестве, поэтому, когда его уровень возрастает, у женщины появляются характерные симптомы, среди которых прекращение менструации и бесплодие, оволосение по мужскому типу и некоторые другие. Изменение гормонального фона требует срочной коррекции, поскольку это может стать причиной развития множества патологий в организме женщины.
Андрогены вырабатываются яичниками, адипоцитами и надпочечниками. И они влияют не только на какие-то внешние проявления, но и на работу внутренних органов, в том числе почек, печени, репродуктивной системы, костно-мышечной системы.
Разновидности и причины возникновения
В зависимости от того, какой орган начинает продуцировать большое количество андрогенов, выделяют несколько форм этого патологического состояния. Наиболее распространённая форма – это яичниковая гиперандрогения , при которой избыток гормонов продуцируется яичниками. Обычно это связано с такими патологиями, как поликистоз яичников или опухоли органа, способные продуцировать андрогены.
Чаще всего такая форма патологии носит наследственный характер – если возрастание выработки андрогенов наблюдалось у матери, то высока вероятность, что недуг проявиться и у её потомства. Накапливаясь, андрогены и становятся причиной развития такого патологического состояния, как гиперандрогения. Также причины развития этой формы гиперандрогении могут крыться в нарушениях работы гипоталамуса и гипофиза, отвечающих за нормальный гормональный фон женского организма.
Вторая форма – надпочечниковая гиперандрогения , которая может встречаться у девочек уже в раннем возрасте. Причины развития этой формы заключаются в недостаточности ферментов, обеспечивающих продукцию гормонов надпочечников.
Центральная форма патологии развивается в тех случаях, когда гипофиз или гипоталамус поражены опухолью. Но также есть ещё и периферическая форма, которая возникает как следствие сахарного диабета и при нарушениях жирового обмена.
Наиболее часто встречающейся является смешанная гиперандрогения , которая обусловлена сразу несколькими нарушениями. Это может быть надпочечниковая гиперандрогения и нарушение яичникового генеза или яичникового и центрального генеза и т. д.
Гиперандрогения и беременность
Как уже упоминалось выше, гиперандрогения может стать причиной у девочек и. Но бывают такие исключительные случаи, когда женщина с такой патологией все же может забеременеть, и тогда ей следует быть готовой к тому, что гиперандрогения при беременности преимущественно заканчивается непроизвольным выкидышем. В тех случаях, если выкидыш не произошёл, высока вероятность замирания плода в утробе матери с необходимостью механической чистки полости матки для его эвакуации.
Все это неблагоприятно сказывается на здоровье женщины и ещё больше усугубляет проблему гормонального дисбаланса, поэтому чтобы подобного не произошло, диагностика гиперандрогении должна проводиться до зачатия, чтобы в последующем, после лечения, у женщины был шанс стать матерью прекрасного малыша.
Конечно же, не во всех случаях гиперандрогения и нормальная беременность являются несовместимыми понятиями – если гормональные нарушения развились на поздних сроках, есть риск преждевременных родов, но малыш при этом будет здоровым. Поэтому очень важно своевременно становиться на учёт в женскую консультацию – врач может не только определить патологию на ранних сроках, но и успешно лечить её, дав женщине возможность выносить ребёнка.
Симптомы
Как уже было сказано выше, синдром гиперандрогении у девочек можно определить в самом маленьком возрасте. Это такие симптомы нарушения гормонального фона, как:
- гипертрофия клитора;
- частичное сращение больших половых губ;
- повышенное оволосение по мужскому типу (срединная полоса живота, подбородок и щеки, грудь.).
У девочек, которые страдают этой болезнью в подростковом возрасте, не начинается менструация, а если болезнь встречается у женщин, наступает прекращение менструального цикла. Другие симптомы такой патологии, как гиперандрогения - это:
- выпадение волос на голове;
- появление кожных высыпаний на лице и теле (по типу акне);
- выраженная сухость кожных покровов, шелушение.
Также у девочек и женщин отмечаются метаболические нарушения, проявляемые чаще всего различной стадии, а также атрофией мышц. В некоторых случаях женский голос может огрубеть и стать похожим на мужской – чаще всего такой симптом проявляется у взрослых женщин. Если же гиперандрогения у женщин развивается в молодом возрасте, высока вероятность того, что их мышечный корсет увеличится, из-за чего тело приобретёт мужественный рельеф и большой мышечный массив.
Конечно же, есть и общие симптомы патологического состояния у женщин. К ним относятся:
- раздражительность;
- утомляемость;
- восприимчивость к инфекциям вследствие снижения иммунитета и т. д.
Диагностика и лечение
Поставить диагноз, основываясь только на внешних проявлениях патологии, невозможно. Поэтому врач назначает пациенткам лабораторное исследование, позволяющее оценить гормональный фон, в том числе и уровень андрогенов. Также показано проведение УЗИ исследования, которое даст специалисту возможность выявить причины заболевания, без чего эффективное лечение невозможно.
Лечение зависит от формы патологии, обнаруженной у женщины. В частности, если у неё гиперандрогения яичникового генеза, показан приём антиандрогенных оральных контрацептивов. А для утилизации избытка гормонов показано применение таких лекарственных средств, как Метипрет и Дексаметазон. Эти средства повышают уровень женских гормонов, а те, в свою очередь, утилизируют излишки мужских.
Когда причиной развития патологии становится опухоль, требуется её оперативное удаление с последующим лечением, которое будет подбираться для пациентки индивидуально в каждом конкретном случае.
Если у девочек или женщин диагностирована надпочечниковая гиперандрогения, то её лечение будет заключаться в назначении глюкокортикоидных гормонов - тот самый вышеописанный Дексаметазон. Отметим, что проще всего лечить болезнь яичникового генеза, поскольку современная фармацевтическая промышленность предлагает большое количество средств, способных стабилизировать гормональных фон женщины. Надпочечниковая гиперандрогения и смешанная форма патологии труднее поддаются лечению, и представительницам прекрасного пола требуется в течение длительного времени (а то и всю жизнь) употреблять прописанные врачом препараты.
Лечить болезнь народными методами можно, но их эффективность очень низкая. Тем не менее есть некоторые травы, обладающие гормоностабилизирующим эффектом, поэтому если их пить в виде настоев и отваров, они могут немного улучшить состояние женщины. Правда, лечить таким образом патологию можно только после консультации со специалистом.
Все ли корректно в статье с медицинской точки зрения?
Ответьте только в том случае, если у вас есть подтвержденные медицинские знания
Заболевания со схожими симптомами:
Авитаминоз - это болезненное состояние человека, которое наступает в результате острой недостачи витаминов в организме человека. Различают весенний и зимний авитаминоз. Ограничений, что касается пола и возрастной группы, в этом случае нет.
Синдром Иценко-Кушинга – патологический процесс, на формирование которого влияют высокие показатели уровня гормонов глюкокортикоидов. Главным из них является кортизол. Терапия заболевания должна быть комплексной и направленой на купирование причины, способствующей развитию недуга.
Гиперандрогенией называют эндокринное заболевание, при котором отмечается чрезмерная секреция мужских половых гормонов у женщин. К проявлениям этой патологии стоит отнести нарушения менструального цикла и репродуктивной деятельности в целом. Нередко женщины жалуются на себорею, гирсутизм, акне и алопецию. Прежде чем понять, как понизить уровень андрогена и можно ли вылечить гиперандрогению у женщин, важно правильно определить причины появления заболевания.
Для постановки правильного диагноза обычного осмотра мало, врач назначает гормональный скрининг, ультразвуковую диагностику яичников, а также компьютерную томографию гипофиза и надпочечников. По результатам обследования назначаются специальные препараты, в основном гормональные. Если результаты обследования показали, что у женщины имеется опухоль любого характера, то назначают только оперативное лечение.
Несколько слов о яичниковой и смешанной гиперандрогении
Оперативное лечение поликистоза яичников может осуществляться несколькими способами, это:
- клиновидная резекция;
- демедуляция яичников, при которой может делаться надсечка фолликулярных образований;
- термокаутеризация;
- электрокаутеризация.
Два последние метода считаются альтернативой резекции яичников. В подобных ситуациях применяется лапароскопический метод.
Сложнее всего вылечить смешанную гиперандрогению, особенно это касается случаев, при которых женщина в будущем планирует обзавестись потомством. Обычно после обследования врач назначает незначительную дозу дексаметазона, которую нужно принимать на протяжении одного года. Этот препарат способен приостановить выработку мужских половых гормонов в надпочечниках. При приеме этого препарата осуществляется контроль содержания в крови кортизола. В норме он не должен превышать отметку 5мкг%. Через год приема этого лекарственного средства гормональный фон пациентки обследуется. Если выявляется, что большая часть андрогенов вырабатывается не надпочечниками, а, например, яичниками, то ход терапии будет изменен. В таких ситуациях врач назначает прием малых доз оральных контрацептивов.
Схема лечения может быть и другой, она также может меняться, что зависит от установленной формы патологии и источника ее происхождения.
Применение препаратов для лечения гиперандрогении
Гормональный фон женщины оказывает влияние на многие процессы, в частности это касается ее репродуктивной функции. Что касается мужчин, сбой их гормонального фона приводит к сексуальным расстройствам, это может быть простое снижение сексуального влечения или импотенция.
К симптомам проявления гиперандрогении у женщин стоит отнести:

- обильный рост волос на теле и лице;
- облысение определенных участков головы;
- уменьшение молочных желез;
- изменение тембра голоса;
- сбои менструального цикла и прочие.
Для подавления выработки андрогенов в женском организме врач назначает препараты-антиандрогены, которые представлены в виде оральных контрацептивов. Для улучшения их действия могут назначаться препараты растительного происхождения, только их подбирают индивидуально, учитывая все особенности организма и восприимчивость к компонентам.
Женщины старшего возраста, наверняка, знают, что такое Цимифуга. Этот компонент входит в состав большинства препаратов на растительной основе. Он предназначен для устранения неприятных симптомов, которые часто встречаются у женщин в климактерическом периоде.
При дисбалансе гормональной системы врач может назначить прием Циклодинона. В состав этого препарата входит такое растение, как прутняк священный.
Кто вылечил гиперандрогению утверждают, что многие растения обладают целебным свойством, они положительно влияют на обменные процессы женского организма, при этом способны регулировать гормональный фон. Особой популярностью пользуется корень солодки, дягиль, мята, пион уклоняющийся и прочие растения, которые в обработанном виде свободно продаются в аптеке. Готовый сбор отпускается без рецепта, а приготовить из него лекарство можно самостоятельно, следуя инструкции. Учитывая такую возможность, нельзя злоупотреблять домашним лечением, поскольку без правильной диагностики и медикаментозного вмешательства не получится эффективно вылечить гиперандрогению.
Нужно помнить, что своевременная диагностика заболевания повышает шансы на успешное лечение данной патологии. Кроме этого следует осознавать, что даже незначительные симптомы могут указывать на наличие той или иной формы гиперандрогении. Сложность лечения этого заболевания заключается в том, что симптомы и признаки могут проявляться не сразу, поэтому распознать тревожный «звоночек» крайне тяжело.
Гиперандрогения – это патология, при которой гормональный фон женщины претерпевает значительные изменения. Происходит выработка слишком большого количества гормона андроген, который считается мужским. В организме женщины данный гормон выполняетмножество необходимых функций, однако его чрезмерное количество приводит к неприятным последствиям, лечение которых обязательно.
Вырабатываются андрогены у женщин адипоцитами, надпочечниками и яичниками. Данные половые гормоны напрямую влияют на процесс полового созревания у женщин, появление волосяного покрова в области гениталий и подмышками. Андрогены регулируют работу печени, почек, а также влияют на мышечный рост и репродуктивную систему. Они необходимы зрелым женщинам, поскольку синтезируют эстроген, поддерживают на достаточном уровне либидо и укрепляют ткани костей.
Что это такое?
Гиперандрогения у женщин – собирательный термин, который включает в себя целый ряд синдромов и заболеваний, сопровождающихся абсолютным или относительным повышением концентрации мужских половых гормонов в крови женщины.
Причины возникновения
Можно выделить следующие главные причины данного синдрома:
- наличие опухолей надпочечников;
- неправильная выработка особого фермента, синтезирующего андрогены, в результате чего происходит их чрезмерное накопление в организме;
- патологии щитовидной железы (гипотериоз), опухоли гипофиза;
- заболевания и сбои в работе яичников, провоцирующие излишнюю выработку андрогенов;
- ожирение в детском возрасте;
- длительный прием стероидов во время профессиональных занятий силовыми видами спорта;
- генетическая предрасположенность.
При нарушениях работы яичников, увеличении коры надпочечников, гиперчувствительности клеток кожи к воздействию тестостерона, опухолях половых и щитовидных желез возможно развитие патологии и в детском возрасте.
Врожденная гиперандрогения иногда не позволяет с точностью установить пол родившегося ребенка. У девочки могут отмечаться большие половые губы, увеличенный до размеров пениса клитор. Внешний вид внутренних половых органов соответствует норме.
Одной из разновидностей адреногенитального синдрома является сольтеряющая форма. Заболевание носит наследственный характер и обычно выявляется в первые месяцы жизни ребенка. В результате неудовлетворительной работы надпочечников у девочек появляется рвота, диарея, судороги.
В старшем возрасте гиперандрогения вызывает избыточный рост волос по всему телу, задержку формирования молочных желез и появление первых месячных.
Классификация
В зависимости от уровня мужских половых гормонов в крови выделяют гиперандрогению:
- абсолютную (концентрация их превышает нормальные значения);
- относительную (уровень андрогенов находится в пределах нормы, однако они усиленно метаболизируются в более активные формы либо же чувствительность к ним органов-мишеней значительно повышена).
В большинстве случаев причиной гиперандрогении является синдром поликистозных яичников. Также она имеет место при:
- адреногенитальном синдроме;
- синдроме галактореи-аменореи;
- новообразованиях надпочечников или яичников;
- гипофункции щитовидной железы;
- синдроме Иценко-Кушинга и некоторых других патологических состояниях.
- приеме женщиной анаболических стероидов, препаратов мужских половых гормонов и циклоспорина.
В зависимости от происхождения выделяют 3 формы этой патологии:
- овариальную (яичниковую);
- надпочечниковую;
- смешанную.
Если корень проблемы находится именно в этих органах (яичниках или коре надпочечников), гиперандрогению называют первичной. В случае патологии гипофиза, обусловливающей нарушения регуляции синтеза андрогенов, ее расценивают как вторичную. Кроме того, это состояние может передаваться по наследству либо же развиваться в течение жизни женщины (то есть являться приобретенным).
Симптомы гиперандрогении
Среди всех симптомов гиперандрогении у женщин преобладают следующие:
- Гирсутизм – избыточный рост волос у женщин, так называемое оволосение по мужскому типу, является самым частым признаком гиперандрогении. О нем можно говорить при появлении волос на животе по срединной линии, на лице, груди. Вместе с тем на голове возможны залысины.
- Следует различать этот симптом от гипертрихоза – избыточный рост волос, не зависимый от андрогенов, который может быть как врожденным, так и приобретенным (при различных заболеваниях, например при порфириях). Надо также обращать внимание на расовую принадлежность пациентки – так у эскимосок и женщин выходцев из среднеазиатских стран оволосение более выражено, нежели у женщин в Европе или Северной Америке.
- Сыпь на лице, акне, признаки шелушения. Часто такие дефекты на лице бывают в период подросткового возраста на фоне гормональной перестройки организма. При гиперандрогении у женщин косметические дефекты на лице длятся гораздо дольше, при этом ни лосьоны, ни кремы от этой проблемы не спасают.
- Опсоолигоменорея (укороченные и разделенные длительным промежутком месячные), аменорея (отсутствие месячных) и бесплодие – чаще всего данный симптом встречается при поликистозе яичников, сопровождающимся гиперандрогенией.
- Избыточный вес. Лишний вес у женщин становится частой причиной гормонального сбоя, при котором нарушается менструальный цикл.
- Атрофия мышц конечностей, мышц живота, остеопароз, атрофия кожи – наиболее характерно для синдрома Кушинга (или Иценко-Кушинга в русскоязычной литературе).
- Повышенный риск инфицирования. В результате гормонального сбоя нарушается функционирование многих органов и систем, что разрушительно сказывается на иммунитете, увеличивая риск попадания и развития инфекций.
- Нарушение толерантности к глюкозе – преимущественно при поражении надпочечников, часто так же и при патологии со стороны яичников.
- Формирование наружных половых органов промежуточного типа (гипертрофия клитора, мочеполовой синус, частичное сращение больших половых губ) – выявляется сразу после рождения или в раннем детском периоде; чаще при врожденной гиперплазии коры надпочечников.
- Артериальная гипертония, гипертрофия миокарда, ретинопатия (невосполительное повреждение сетчатки глаза).
- Депрессия, сонливость, повышенная утомляемость – связано кроме всего с тем, что нарушается секреция глюкокортикоидов надпочечников.
Синдром гиперандрогении может быть связан с некоторыми заболеваниями. Итак, среди причин повышенного уровня андрогенов можно выделить:
- Синдром гиперандрогении может быть связан с синдромом Кушинга. Причина развития данной патологии кроется в надпочечниках в результате избыточной выработки глюкокортикоидов. Среди симптомов данного заболевания можно выделить: округлое лицо, увеличенная шея, отложение жира в области живота. Могут наблюдаться сбои менструального цикла, бесплодие, эмоциональные расстройства, сахарный диабет, остеопороз.
- Синдром Штейна-Левенталя. При этом синдроме в яичниках образуются кисты, но не те, которые требуют немедленного оперирования, а временные. Характерным явлением для синдрома поликистоза яичников является увеличение яичника перед менструацией и уменьшение его после того, как месячные пройдут. При данном синдроме наблюдается отсутствие овуляции, бесплодие, повышенное оволосение, избыточный вес. Происходит нарушение выработки инсулина, в результате чего у больных может развиться сахарный диабет.
- Возрастная гиперплазия яичников. Наблюдается в достаточно зрелом возрасте у женщин в результате нарушения баланса между эстрадиолом и эстроном. Проявляется в виде гипертонии, сахарного диабета, избыточного веса, онкологии матки.
При гиперандрогении практически невозможно забеременеть в связи с отсутствием овуляции. Но все же иногда женщине удается зачать ребенка, но выносить его, к сожалению, становится невозможно. У женщины на фоне гиперандрогении случается выкидыш или происходит замирание плода в материнском утробе.
Гиперандрогения у беременных женщин
Гиперандрогения при беременности становится одной из самых распространенных причин развития самопроизвольного аборта, который чаще всего происходит на ранних сроках. Если это заболевание выявлено уже после зачатия и вынашивания ребенка, определить, когда оно точно возникло достаточно трудно. В данном случае врачей мало интересуют причины развития гиперандрогении, поскольку нужно предпринять все меры для сохранения беременности.
Признаки патологии у женщин в положении ничем не отличаются от симптомов, которые наблюдают в любое другое время. Невынашивание беременности в большинстве случаев связано с тем, что плодное яйцо не способно хорошо прикрепиться к стенке матки из-за гормонального дисбаланса в организме. В результате даже при незначительном негативном внешнем воздействии происходит выкидыш. Он почти всегда сопровождается кровянистыми выделениями из влагалища, тянущими болями внизу живота. Также такая беременность характеризуется не столь выраженным токсикозом, который присутствует у большинства женщин в первом триместре.
Осложнения
Спектр возможно осложнений при всех описанных выше заболеваниях крайне велик. Можно отметить только некоторые, самые важные:
- Метастазирования злокачественных опухолей – осложнение, более характерное для опухолей надпочечников.
- При врожденной патологии возможны аномалии развития, самые распространенные из них - аномалии развития половых органов.
- Осложнения со стороны других систем органов, которые подвергаются негативному влиянию изменения гормонального фона при патологии надпочечников, гипофиза и яичников: хроническая почечная недостаточность, патология щитовидной железы и т.д.
Этим простым перечислением список далеко не окончен, что говорит в пользу своевременного обращения к врачу, дабы предвосхитить их наступление. Только своевременная диагностика и квалифицированное лечение способствуют достижению положительных результатов.

Гирсутизм
Диагностика
Диагностика гиперандрогении у женщин в условиях клинической лаборатории:
- Определяется количество кетостероидов-17 в урине;
- Определение основного гормонального уровня. Выясняют, каково количество пролактина, свободного и общего тестостерона, дегидроэпиандростерона сульфата, андростендиона и уровня ФСГ в плазме крови. Забор материала производится утром, натощак. Из-за постоянного изменения гормонального фона, больным гиперандрогенией пробу делают трижды, с промежутками между процедурами 30 минут, затем все три порции крови смешивают. Дегидроэпиандростерона сульфат, в количестве более 800 мкг%, говорит о наличии андрогенсекретирующей опухоли надпочечников;
- Берут маркер на определение ХГ (в случае, когда признаки гиперандрогении есть, но основной уровень андрогенов остается нормальным).
Исследование инструментальное: больную с подозрением на гиперандрогению направляют на МРТ, КТ, внутривлагалищное УЗИ (для визуализации опухолевых образований).
Лечение гиперандрогении
Выбор лечения гиперандрогении во многом зависит от фонового заболевания, которое явилось причиной развития этого патологического состояния, а также от тяжести течения заболевания и выраженности лабораторных признаков гиперандрогении.
В связи с этим, ведение пациентов и определение тактики лечения должно быть преимущественно индивидуальным, с учетом всех особенностей каждой конкретной пациентки. Во многих ситуациях лечение гиперандрогении подразумевает проведение целого комплекса лечебных мероприятий как консервативного, так и оперативного направления.
- нормализация массы тела;
- регулярные занятия спортом (хорошо подойдут ходьба, бег, аэробика и плавание);
- специальная гипокалорийная диета (объем потраченных калорий должен быть больше приобретенных).
Медикаментозная терапия:
- агонисты гонадотропин-рилизинг гормона (снижение выработки андрогенов и эстрогенов яичниками);
- эстроген-гестагенные препараты (стимуляция образования женских гормонов);
- антиандрогены (подавление избыточного выделения андрогенов как надпочечниками, так и яичниками);
- препараты с высоким содержанием гормона яичников (прогестерона).
Лечение сопутствующих патологий:
- заболевания щитовидной железы и печени;
- СПЯ (синдром поликистозных яичников), когда избыточная выработка мужских половых гормонов сопровождается отсутствием овуляции;
- АГС (адреногенитальный синдром).
Хирургическое вмешательство:
- удаление гормонопродуцирующих опухолей.
Косметологические виды коррекции:
- обесцвечивание нежелательных волос;
- в домашних условиях - выщипывание и бритье;
- в салоне красоты - депиляция, электролиз, удаление волос с помощью воска или лазера.

Синдром поликистоза яичников, являющийся самой распространенной причиной яичниковой гиперандрогении, во многих случаях хорошо поддается консервативному лечению с применением целого спектра гормональных препаратов.
При синдроме Кушинга с признаками гиперандрогении у пациенток, страдающих онкологическими патологиями надпочечников, единственным эффективным методом лечения является хирургический.
Лечение врожденной гиперплазии надпочечников следует начинать еще в стадии внутриутробного развития ребенка, так как данная патология приводит к развитию тяжелой степени гиперандрогении.
В ситуации, когда гиперандрогения у пациентки является симптомом андрогенсекретирующей опухоли яичника, единственным действенным вариантом лечения является сочетание оперативной, лучевой и химиопрофилактической терапии.
Лечение женщин, страдающих гиперандрогенией в постменопаузальном периоде, заключается в назначении Климена по общепринятой схеме, обладающего выраженным антиандрогенным эффектом.
Меры профилактики
Профилактика заключается в следующем:
- регулярное (2-3 раза в год) посещение гинеколога;
- минимизация повышенных нагрузок (как психоэмоциональных, так и физических);
- отказ от вредных привычек (курение, злоупотребление алкоголем);
- сбалансированное и рациональное питание: отдайте предпочтение продуктам, богатым клетчаткой, и откажитесь от жареной и острой пищи, а также консервации;
- своевременное лечение заболеваний печени, щитовидной железы и надпочечников.
Можно ли зачать и выносить здорового ребенка с таким диагнозом? Да, вполне. Но с учетом повышенного риска выкидыша, сделать это непросто. Если о проблеме вы узнали на этапе планирования беременности, следует сначала нормализовать гормональный фон. В том случае, когда диагноз был поставлен уже «по факту», тактику дальнейшей терапии (которая, заметим, не всегда является необходимой) определит лечащий врач, а вам останется только безоговорочно выполнять все его рекомендации.
– группа эндокринопатий, характеризующихся избыточной секрецией или высокой активностью мужских половых гормонов в женском организме. Проявлениями различных синдромов, схожих по симптоматике, но различных по патогенезу, выступают нарушения обменной, менструальной и репродуктивной функций, андрогенная дермопатия (себорея, акне, гирсутизм, алопеция). Диагноз гиперандрогении у женщин основан на данных осмотра, гормонального скрининга, УЗИ яичников, КТ надпочечников и гипофиза. Коррекцию гиперандрогении у женщин проводят с помощью КОК или кортикостероидов, опухоли удаляют оперативно.

Общие сведения
Гиперандрогения у женщин – понятие, объединяющее патогенетически разнородные синдромы, обусловленные повышенной продукцией андрогенов эндокринной системой или чрезмерной восприимчивостью к ним тканей–мишеней. Значимость гиперандрогении в структуре гинекологической патологии объясняется ее широким распространением среди женщин детородного возраста (4–7,5% у девочек-подростков, 10-20% у пациенток старше 25 лет).
Андрогены - мужские половые гормоны группы стероидов (тестостерон, АСД, ДГЭА-С, ДГТ) синтезируются в организме женщины яичниками и корой надпочечников, меньше - подкожной жировой клетчаткой под контролем гипофизарных гормонов (АКТГ и ЛГ). Андрогены выступают предшественниками глюкокортикоидов, женских половых гормонов – эстрогенов и формируют либидо. В пубертате андрогены являются наиболее значимыми в процессе ростового скачка, созревания трубчатых костей, замыкания диафизаро-эпифизарных хрящевых зон, появления оволосения по женскому типу. Однако избыток андрогенов в женском организме вызывает каскад патологических процессов, нарушающих общее и репродуктивное здоровье.
Гиперандрогения у женщин не только обусловливает возникновение косметических дефектов (себореи , акне , алопеции , гирсутизма , вирилизации), но и становится причиной расстройства метаболических процессов (обмена жиров и углеводов), менструальной и репродуктивной функции (аномалий фолликулогенеза, поликистозной дегенерации яичников, дефицита прогестерона, олигоменореи , ановуляции, невынашивания беременности, бесплодия у женщин). Продолжительная гиперандрогения в сочетании с дисметаболизмом повышает риск развития гиперплазии эндометрия и рака шейки матки , сахарного диабета II типа и сердечно-сосудистой патологии у женщин.

Причины гиперандрогении у женщин
Развитие транспортной формы гиперандрогении у женщин отмечается на фоне недостаточности глобулина, связывающего половые стероиды (ГСПС), блокирующего активность свободной фракции тестостерона (при синдроме Иценко-Кушинга , гипотиреозе, дислипопротеидемии). Компенсаторный гиперинсулизм при патологической инсулинорезистентности клеток-мишеней способствует усилению активации андрогенсекретирующих клеток овариально-адреналового комплекса.
У 70–85% женщин с акне гиперандрогения наблюдается при нормальных показателях андрогенов в крови и повышенной чувствительности к ним сальных желез вследствие увеличения плотности гормональных рецепторов кожи. Основной регулятор пролиферации и липогенеза в сальных железах - дигидротестостерон (ДГТ) - стимулирует гиперсекрецию и изменение физико–химических свойств кожного сала, приводящих к закрытию выводных протоков сальных желез, образованию комедонов, появлению акне и угревой болезни.
Гирсутизм связан с гиперсекрецией андрогенов в 40-80% случаев, в остальных – с усиленным превращением тестостерона в более активный ДГТ, провоцирующий избыточный рост стержневых волос в андрогенчувствительных зонах женского тела или выпадение волос на голове. Кроме этого, у женщин может встречаться ятрогенная гиперандрогения, обусловленная приемом лекарственных препаратов с андрогенной активностью.
Симптомы гиперандрогении у женщин
Клиника гиперандрогении у женщин зависит от степени выраженности нарушений. При гиперандрогении неопухолевого генеза, например, при СПКЯ , клинические признаки медленно прогрессируют в течение нескольких лет. Начальные симптомы манифестируют в период пубертата, клинически проявляясь жирной себореей, вульгарными угрями, нарушением менструального цикла (нерегулярностью, чередованием задержек и олигоменореи, в тяжелых случаях - аменореей), избыточным оволосением лица, рук, ног. В последующем развивается кистозная трансформация структуры яичников, ановуляция, недостаточность прогестерона, относительная гиперэстрогенемия, гиперплазия эндометрия, снижение фертильности и бесплодие. В постменопаузе отмечается выпадение волос сначала в височных областях (битемпоральная алопеция), затем в теменной области (париетальная алопеция). Выраженная андрогенная дерматопатия у многих женщин приводит к развитию невротических и депрессивных состояний.
Гиперандрогения при АГС характеризуется вирилизацией гениталий (женским псевдогермафродитизмом), маскулинизацией , поздним менархе, недоразвитием груди, огрублением голоса, гирсутизмом, угрями . Тяжелая гиперандрогения при нарушении функции гипофиза сопровождается высокой степенью вирилизациии, массивным ожирением по андроидному типу. Высокая активность андрогенов способствует развитию метаболического синдрома (гиперлипопротеинемии, инсулинорезистентности, СД II типа), артериальной гипертензии , атеросклероза , ИБС . При андрогенсекретирующих опухолях надпочечников и яичников симптомы развиваются стремительно и быстро прогрессируют.
Диагностика гиперандрогении у женщин
В целях диагностики патологии проводится тщательный сбор анамнеза и физикальный осмотр с оценкой полового развития, характера менструальных нарушений и оволосения, признаков дермопатии; определяется общий и свободный тестостерон, ДГТ, ДЭА-С, ГСПС в сыворотке крови. Выявление избытка андрогенов требует уточнения его природы - надпочечниковой или яичниковой.
Маркером адреналовой гиперандрогении служит повышенный уровень ДГЭА-С, а яичниковой - увеличение количества тестостерона и АСД. При очень высоком уровне ДГЭА-С >800 мкг/дл или общего тестостерона >200 нг/дл у женщин возникает подозрение на андрогенсинтезирующую опухоль, что требует выполнения КТ или МРТ надпочечников, УЗИ органов малого таза, при сложности визуализации новообразования - селективной катетеризации надпочечниковых и яичниковых вен. УЗ-диагностика позволяет также установить наличие поликистозной деформации яичников.
При овариальной гиперандрогении оценивают показатели гормонального фона женщины: уровни пролактина, ЛГ, ФСГ, эстрадиола в крови; при адреналовой - 17-ОПГ в крови, 17-КС и кортизола в моче. Возможно проведение функциональных проб с АКТГ, проб с дексаметазоном и ХГЧ, выполнение КТ гипофиза. Обязательным является исследование углеводного и жирового обмена (уровней глюкозы, инсулина, HbA1C, общего холестерина и его фракций, глюкозо-толерантного теста). Женщинам с гиперандрогенией показаны консультации эндокринолога, дерматолога, генетика.
Лечение гиперандрогении у женщин
Лечение гиперандрогении длительное, требующее дифференцированного подхода к тактике ведения пациенток. Основным средством коррекции гиперандрогенных состояний у женщин выступают эстроген-гестагенные оральные контрацептивы с антиандрогенным эффектом. Они обеспечивают торможение продукции гонадотропинов и процесса овуляции, подавление секреции овариальных гормонов, в т. ч., тестостерона, подъем уровня ГСПС, блокировку андрогеновых рецепторов. Гиперандрогению при АГС купируют кортикостероидами, их применяют также для подготовки женщины к беременности и в период гестации при данном типе патологии. В случае высокой гиперандрогении курсы антиандрогенных препаратов у женщин продлевают до года и более.
При андрогензависимой дерматопатии клинически эффективна периферическая блокада андрогенных рецепторов. Одновременно проводится патогенетическое лечение субклинического гипотиреоза, гиперпролактинемии и др. нарушений. Для лечения женщин с гиперинсулизмом и ожирением применяются инсулиновые сенситайзеры (метформин), меры по снижению веса (гипокалорийная диета, физические нагрузки). На фоне проводимого лечения осуществляется контроль динамики лабораторных и клинических показателей.
Андрогенсекретирующие опухоли яичников и надпочечников имеют обычно доброкачественную природу, но при их выявлении обязательно хирургическое удаление. Рецидивы маловероятны. При гиперандрогении показано диспансерное наблюдение и медицинское сопровождение женщины для успешного планирования беременности в будущем.
